Kit de PCR directe per a la sang
Característiques
■ Senzill i ràpid: l'amplificació per PCR es pot realitzar directament utilitzant la sang com a plantilla, sense la necessitat dels tediosos passos de preparació de mostres i extracció d'ADN.
■ Alta puresa: el salt del pretractament de la mostra i els passos d’extracció d’ADN poden ajudar a evitar la contaminació creuada de les mostres.
■ Alt rendiment: la identificació per PCR de mostres a gran escala es pot realitzar combinant el kit amb plaques de PCR de 96/384 pous.
■ Forta universalitat: aquest kit pot amplificar de manera eficient fragments de GC elevats o fragments amb estructura secundària complexa, i la longitud de l'amplificació pot arribar a ser de 5 kb.
■ Forta resistència a l'estrès: aquest kit es pot aplicar a diverses espècies i mostres de sang conservades de diferents maneres.
Aplicacions
Els productes PCR d’aquest kit contenen “A” a l’extrem 3 ′, que es pot utilitzar directament per a la clonació de vectors TA. Aquest kit es pot utilitzar per a l'amplificació de fragments d'ADN genòmic, anàlisi genètica d'alt rendiment i anàlisi de genotipatge (com ara la detecció de gens).
Tots els productes es poden personalitzar per ODM / OEM. Per obtenir més informació,feu clic a Servei personalitzat (ODM / OEM)
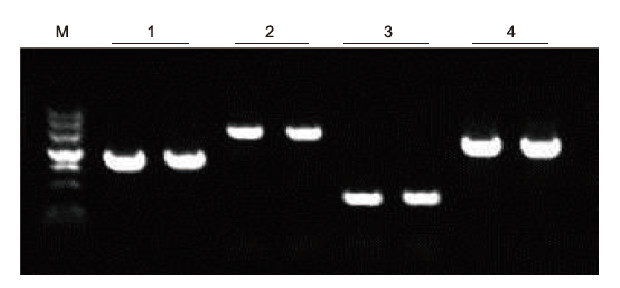 |
Utilitzant l’anticoagulació EDTA humana com a plantilla, es van amplificar 4 gens amb diferents continguts de GC mitjançant el kit de PCR directe. El sistema de reacció de PCR era de 20 μl i es feia servir 1 μl de sang com a plantilla. M: TIANGEN Marker II; 1: mida del fragment 1090 pb, contingut GC 68,1%; 2: mida del fragment 1915 pb, contingut GC 70,4%; 3: mida del fragment 448 pb, contingut GC 74,8%; 4: mida del fragment 1527 pb, contingut GC 61,5%. Resultats experimentals: el kit de PCR de sang directa pot amplificar de manera efectiva fragments d’ADN amb contingut de GC en el rang del 61,5% al 74,8%, cosa que suggereix que és capaç d’amplificar fragments amb alt contingut de GC. |
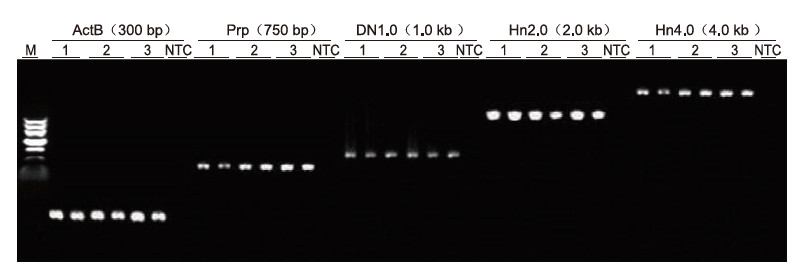 |
Utilitzant l’anticoagulació EDTA humana com a plantilla, es van amplificar cinc gens amb diferents longituds (ActB, Prp, DN1.0, Hn2.0 i Hn4.0) mitjançant el kit de PCR Blood Direct. El sistema de reacció de PCR era de 20 μl i es feia servir 1 μl de sang com a plantilla. M: TIANGEN Marker II; 1-3: 3 mostres de sang diferents; NTC: control sense primers. Resultats experimentals: el kit de PCR Blood Blood pot amplificar fragments amb una longitud de fins a 4 kb, suggerint que és capaç d'amplificar fragments llargs. |
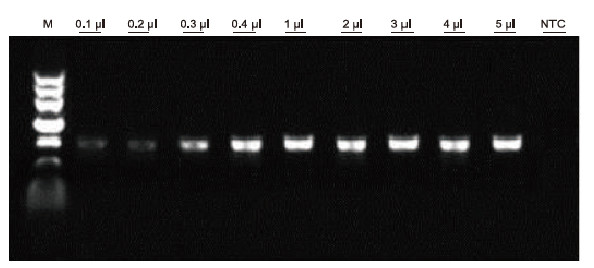 |
Utilitzant l’anticoagulació EDTA humana com a plantilla, es va utilitzar Blood PCR Kit per a la detecció de PCR de diferents mostres de sang. El sistema de reacció per PCR era de 20 μl i es feia servir 1 μl de sang com a plantilla. M: TIANGEN Marker II; 1-9: la quantitat de càrrega de sang és de 0,1 μl, 0,2 μl, 0,3 μl, 0,4 μl, 1 μl, 2 μl, 3 μl, 4 μl i 5 μl, respectivament; NTC: control sense plantilla Resultats experimentals: el kit de PCR Blood Direct té una forta resistència a la sang i pot amplificar les mostres de sang amb un rang de càrrega de 0,1-5 μl. |
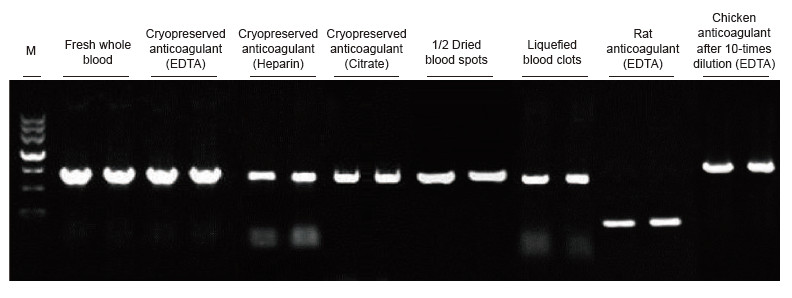 |
Es van utilitzar com a plantilles mostres de sang d’espècies humanes, de rates, de pollastre i d’altres espècies amb diferents tractaments. El kit de PCR directe de sang es va utilitzar per amplificar PRNP (humans, 750 pb), Actina (rata, 200 pb) i β-Actina (pollastre, 1,0 kb). El sistema de reacció per PCR era de 20 μl i es feia servir 1 μl de sang com a plantilla. M: Marcador TIANGEN II. Resultats experimentals: el kit de PCR directe de sang es pot aplicar a una àmplia gamma de mostres i la detecció directa de PCR es pot realitzar en mostres de sang de diverses espècies amb diferents tractaments. |
Plantilla A-1
■ La plantilla conté impureses de proteïnes o inhibidors de Taq, etc. —Purifiqueu la plantilla d’ADN, elimineu les impureses de proteïnes o extraieu l’ADN de la plantilla amb kits de purificació.
■ La desnaturalització de la plantilla no està completa: augmentar adequadament la temperatura de desnaturalització i allargar el temps de desnaturalització.
■ Degradació de la plantilla: preparar de nou la plantilla.
A-2 Primer
■ Mala qualitat dels primers: —Resintetitzeu el primer.
■ Degradació del cebador ——Aliquot els primers d’alta concentració en petit volum per a la seva conservació. Eviteu la congelació i descongelació múltiples o crioconservació a llarg termini de 4 ° C.
■ Disseny inadequat d’imprimacions (per exemple, la longitud de l’imprimació no és suficient, dímer format entre imprimacions, etc.) -Imprimacions de redisseny (evitar la formació de dímers d’imprimació i estructura secundària)
A-3 Mg2+concentració
■ Mg2+ la concentració és massa baixa —— Increment adequat de Mg2+ concentració: Optimitzar el Mg2+ concentració per una sèrie de reaccions d’1 mM a 3 mM amb un interval de 0,5 mM per determinar el Mg òptim2+ concentració per a cada plantilla i imprimació.
A-4 Temperatura de recuit
■ L'alta temperatura de recuit afecta la unió de la imprimació i la plantilla. —— Reduïu la temperatura de recuit i optimitzeu l’estat amb un gradient de 2 ° C.
A-5 Temps d’ampliació
■ Temps d'extensió curt: augmentar el temps d'extensió.
Fenòmens: les mostres negatives també mostren les bandes de seqüència objectiu.
A-1 Contaminació de PCR
■ Contaminació creuada de la seqüència diana o dels productes d'amplificació —— No pipeteu amb precaució la mostra que conté la seqüència diana a la mostra negativa ni vesseu-la del tub de la centrífuga. Els reactius o equips s’han d’autoclavar per eliminar els àcids nucleics existents i s’ha de determinar l’existència de contaminació mitjançant experiments de control negatiu.
■ Contaminació dels reactius ——Aliquoteu els reactius i guardeu-los a baixa temperatura.
A-2 Primer
■ Mg2+ la concentració és massa baixa —— Increment adequat de Mg2+ concentració: Optimitzar el Mg2+ concentració per una sèrie de reaccions d’1 mM a 3 mM amb un interval de 0,5 mM per determinar el Mg òptim2+ concentració per a cada plantilla i imprimació.
■ Disseny incorrecte de la imprimació i la seqüència objectiu té homologia amb la seqüència no objectiu. —— Re-disseny de primers.
Fenòmens: les bandes d'amplificació per PCR són incompatibles amb la mida esperada, ja sigui gran o petita, o de vegades es produeixen bandes d'amplificació específiques i bandes d'amplificació no específiques.
A-1 Primer
■ Poca especificitat de la imprimació
—— Imprimació de redisseny.
■ La concentració d’imprimació és massa elevada: augmenta adequadament la temperatura de desnaturalització i allarga el temps de desnaturalització.
A-2 Mg2+ concentració
■ El Mg2+ la concentració és massa elevada ——Reduïu adequadament la concentració de Mg2 +: optimitzeu el Mg2+ concentració per una sèrie de reaccions d’1 mM a 3 mM amb un interval de 0,5 mM per determinar el Mg òptim2+ concentració per a cada plantilla i imprimació.
A-3 Polimerasa termoestable
■ Quantitat d’enzim excessiu —— Reduïu adequadament la quantitat d’enzim a intervals de 0,5 U.
A-4 Temperatura de recuit
■ La temperatura de recuit és massa baixa: augmenta adequadament la temperatura de recuit o adopta el mètode de recuit de dues etapes
A-5 cicles de PCR
■ Hi ha massa cicles de PCR —— Reduïu el nombre de cicles de PCR.
A-1 Primer——Preca especificitat ——Rediseu la imprimació, canvieu la posició i la longitud de la imprimació per millorar la seva especificitat; o realitzar PCR imbricada.
A-2 Plantilla ADN
——La plantilla no és pura ——Purifiqueu la plantilla o extracteu l’ADN amb kits de purificació.
A-3 Mg2+ concentració
——Mg2+ la concentració és massa elevada ——Reduïu adequadament Mg2+ concentració: Optimitzar el Mg2+ concentració per una sèrie de reaccions d’1 mM a 3 mM amb un interval de 0,5 mM per determinar el Mg òptim2+ concentració per a cada plantilla i imprimació.
A-4 dNTP
——La concentració de dNTP és massa alta ——Reduïu adequadament la concentració de dNTP
A-5 Temperatura de recuit
——Temperatura de recuit massa baixa—— Augmenteu adequadament la temperatura de recuit
Cicles A-6
——Massa cicles ——Optimitzeu el nombre de cicles

El primer pas és triar la polimerasa adequada. La polimerasa Taq regular no es pot revisar a causa de la manca d'activitat d'exonucleasa de 3'-5 ', i el desajust reduirà considerablement l'eficiència de l'extensió dels fragments. Per tant, la polimerasa Taq regular no pot amplificar eficaçment fragments diana de més de 5 kb. La polimerasa Taq amb modificacions especials o una altra polimerasa d'alta fidelitat s'ha de seleccionar per millorar l'eficiència de l'extensió i satisfer les necessitats d'amplificació de fragments llargs. A més, l’amplificació de fragments llargs també requereix un ajust corresponent del disseny de la imprimació, el temps de desnaturalització, el temps d’extensió, el pH de la memòria intermèdia, etc. Per evitar danys a la plantilla, el temps de desnaturalització a 94 ° C s’ha de reduir a 30 segons o menys per cicle i el temps d’elevació de la temperatura a 94 ° C abans de l’amplificació ha de ser inferior a 1 min. A més, establir la temperatura d’extensió a uns 68 ° C i dissenyar el temps d’extensió segons la velocitat d’1 kb / min pot garantir una amplificació efectiva de fragments llargs.
La taxa d'error d'amplificació per PCR es pot reduir mitjançant l'ús de diverses ADN polimerases amb alta fidelitat. Entre totes les ADN polimerases de Taq trobades fins ara, l’enzim Pfu té la taxa d’error més baixa i la fidelitat més alta (vegeu la taula adjunta). A més de la selecció d’enzims, els investigadors poden reduir encara més la velocitat de mutació de la PCR optimitzant les condicions de reacció, inclosa l’optimització de la composició del tampó, la concentració de polimerasa termoestable i l’optimització del nombre de cicles de PCR.
Categories de productes
PER QUÈ ENS TRIEM?
Des de la seva creació, la nostra fàbrica ha estat desenvolupant productes de primer nivell mundial seguint el principi
de qualitat primer. Els nostres productes han guanyat una excel·lent reputació a la indústria i una confiança valuosa entre clients nous i antics.








