Kit TIANScriptⅡ RT
Característiques
■ Alta activitat enzimàtica i eficiència: alta activitat de transcriptasa inversa i bona compatibilitat en experiments posteriors.
■ Àmplia gamma de substrats: apta per a tots els ARN, especialment les plantilles d'ARN amb estructures secundàries complexes.
■ Llarg RT: la síntesi de la primera cadena d'ADNc pot arribar als 12 kb.
■ Funcionament senzill: simplement afegiu els components necessaris en un sol pas sense afegir cap reactiu durant l'operació.
Aplicacions
■ Síntesi de la primera cadena d'ADNc.
■ Construcció de la biblioteca de cDNA.
■ RT-PCR en un pas.
■ Anàlisi de curses.
Tots els productes es poden personalitzar per ODM / OEM. Per obtenir més informació,feu clic a Servei personalitzat (ODM / OEM)
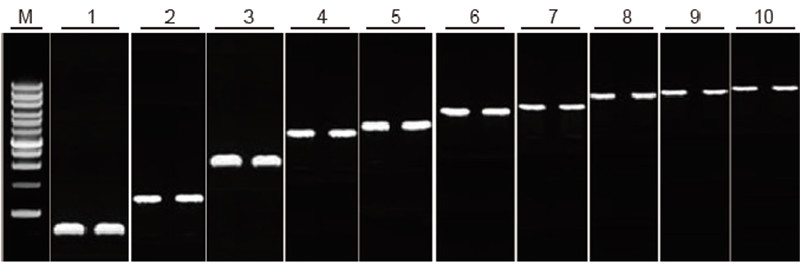 |
Capacitat de transcripció inversa del kit TIANScript II RT per a fragments de diferents longituds Mètode: transcripció inversa: consulteu el manual d'instruccions del kit TIANScript II RT. Resultats: La imatge de gel mostra els resultats d'amplificació de 10 gens diana amb longituds diferents després de la transcripció inversa d'1 μg d'ARN total. Es van carregar 2 μl de productes de transcripció inversa per carril. Sistema d'amplificació (PCR): 20 μl; Càrrega de la mostra: 5 μl; Marcador: escala ADN D15000 + 1 kb; Concentració de gel: 1%; Condicions d’electroforesi: 6 V / cm, 20 min Esquema de cada carril: M: marcador d’ADN; 1: longitud del producte: 120 pb; 2: durada del producte: 1 kb; 3: longitud del producte: 2,5 kb; 4: longitud del producte: 3,2 kb; 5: producte longitud: 4,6 kb; 6: longitud del producte: 6,8 kb; 7: longitud del producte: 7,6 kb; 8: longitud del producte: 8,9 kb; 9: longitud del producte: 10 kb; 10: longitud del producte: 12 kb; |
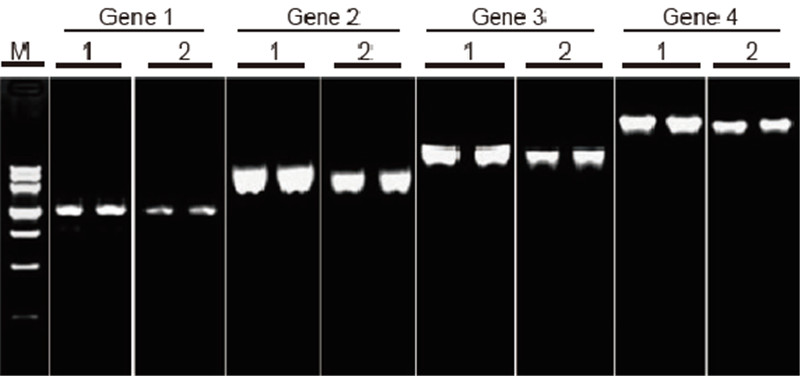 |
Comparació de l'eficiència i l'especificitat del TIANScript II RT Kit i productes d'altres proveïdors en transcripció inversa de plantilles llargues Materials: ARN total de cèl·lules adherents humanes. Quantitat inicial RT-PCR: 2 μl de producte de transcripció inversa (50 ng / μl) Mètode: transcripció inversa: consulteu el manual d'instruccions del kit TIANScript II RT. Resultats: La imatge en gel mostra els resultats d'amplificació de 6 gens diana amb diferents longituds després de la transcripció inversa d'1 μg d'ARN total de cèl·lules adherents humanes mitjançant M-MLV del proveïdor A i el kit TIANGEN TIANScript II RT. Sistema d'amplificació (PCR): 20 μl; Càrrega de la mostra: 5 μl; Marcador: DNA MarkerIII; Concentració de gel: 1%; Condicions d’electroforesi: 6 V / cm, 20 min. Esquema de cada carril: M: marcador d’ADN; 1: Resultats d'amplificació del cDNA invers transcrit mitjançant TIANScriptII RT Kit; 2. Resultats d'amplificació del cDNA invers transcrit mitjançant el producte rellevant del proveïdor A. La longitud del producte del gen 1 és d'1,3 kb; La longitud del producte del gen 2 és de 3,0 kb; La longitud del producte del gen 3 és de 5,0 kb; La longitud del producte del gen 4 és de 7,5 kb. |
L’ARN A-1 es degrada
——Purificar ARN d’alta qualitat sense contaminació. El material d’on s’extreu l’ARN ha de ser el més fresc possible per evitar la degradació de l’ARN. Analitzeu la integritat de l’ARN en gel desnaturalitzat abans de la reacció RT. Després de l'extracció d'ARN, s'ha d'emmagatzemar en formamida al 100%. Si s’utilitza un inhibidor de la RNasa, la temperatura d’escalfament ha de ser <45 ° C i el pH ha de ser inferior a 8,0, en cas contrari l’inhibidor alliberarà tota la RNasa unida. A més, s’hauria d’afegir un inhibidor de la RNasa a solucions que tinguin TDT ≥ 0,8 mM.
L’ARN A-2 conté inhibidors de reaccions de transcripció inversa
—— Els inhibidors de la transcripció inversa inclouen SDS, EDTA, glicerol, pirofosfat sòdic, espermidina, formamida, sal de guanidina, etc. Barregeu l’ARN control amb la mostra i compareu el rendiment amb la reacció de l’ARN control per comprovar si hi ha un inhibidor. Rentar la precipitació d’ARN amb un 70% (v / v) d’etanol per eliminar els inhibidors.
A-3 Recuit insuficient dels primers utilitzats per sintetitzar la primera cadena de cDNA
—— Determineu que la temperatura de recuit és adequada per als primers utilitzats a l’experiment. Per als hexàmers aleatoris, es recomana mantenir la temperatura a 25 ° C durant 10 min abans d’arribar a la temperatura de reacció. Per als primers específics de gens (GSP), proveu altres GSP o canvieu a oligo (dT) o hexàster aleatori.
A-4 Petita quantitat d'ARN inicial
—— Augmenteu la quantitat d'ARN. Per a mostres d'ARN de menys de 50 ng, es pot utilitzar 0,1 μg a 0,5 μg d'acetil BSA en la primera síntesi d'ADNc de cadena
A-5 La seqüència diana no s’expressa en els teixits analitzats.
—— Proveu altres teixits.
Falla la reacció A-6 PCR
——Per RT-PCR en dos passos, la plantilla d'ADNc al pas PCR no pot superar 1/5 del volum de reacció.
A-1 Recuit inespecífic d’imprimacions i plantilles
——L’extrem 3 ’dels primers no ha de contenir 2-3 dG ni dC. Utilitzeu primers específics de gens en la primera síntesi de cadenes en lloc de primers aleatoris o oligo (dT). Utilitzeu una temperatura de recuit més alta en els primers cicles i després una temperatura de recuit més baixa. Utilitzeu l’ADN polimerasa Taq d’arrencada en calent per a PCR per millorar l’especificitat de la reacció.
A-2 Disseny deficient de primers específics de gens
—— Seguiu els mateixos principis per al disseny de la imprimació d'amplificació.
ARN A-3 contaminat amb ADN genòmic
——Tractar ARN amb DNasa de grau PCR I. Establir una reacció de control sense transcripció inversa per detectar la contaminació de l'ADN.
A-4 Formació del dímer de la imprimació
——Disseny de primers sense seqüències complementàries a l'extrem 3 '.
A-5 Mg massa alt2+ concentració
——Optimize Mg2+ concentració per a cada combinació de plantilla i imprimació
A-6 Contaminat amb ADN estrany
—— Utilitzeu consells resistents als aerosols i enzims UDG.
A-1 El contingut del primer producte de la cadena és massa alt
—— Reduïu la quantitat del producte de la primera cadena en el pas de reacció PCR convencional.
A-2 Quantitat d’imprimació massa alta en reacció de PCR
——Reduïu l'entrada inicial.
A-3 Massa cicles
——Optimitzar les condicions de reacció de PCR i reduir el nombre de cicles de PCR.
A-4 Temperatura de recuit massa baixa
—— Augmenteu la temperatura de recuit per evitar una iniciació i una extensió no específiques.
A-5 Amplificació inespecífica de fragments d'oligonucleòtids generats per la degradació de l'ADN per DNasa —Extreure ARN d'alta qualitat per evitar la contaminació de l'ADN.
RT-PCR consisteix a transcriure inversament l'ARN en cDNA i, a continuació, utilitzar l'ADNc transcrit invers com a plantilla per a la reacció de PCR per amplificar el fragment diana. Trieu primers primers aleatoris, Oligo dT i primers específics de gens segons les condicions específiques de l’experiment. Tots els primers es poden utilitzar per a mRNA de cèl·lules eucariotes curtes sense estructura de forquilla.
Imprimació aleatòria: apte per a ARN llargs amb estructura de forquilla, així com per a tot tipus d’ARN com ara ARNm, ARNm, ARNt, etc. S’utilitzen principalment per a reaccions RT-PCR de plantilla única.
Oligo dT: Apte per a ARN amb cua PolyA (ARN procariota, rNAr i eucariota Oligo dT i ARNt no tenen cues PolyA). Com que Oligo dT està lligat a la cua PolyA, cal que la qualitat de les mostres d'ARN sigui elevada, i fins i tot una petita quantitat de degradació reduirà considerablement la quantitat de síntesi d'ADNc de longitud completa.
Primer específic de gens: complementari a la seqüència de plantilla, adequat per a situacions en què es coneix la seqüència diana.
Hi ha dues maneres:
1. Mètode de referència interna: en teoria, l'ADNc és fragments d'ADN de diferents longituds, de manera que el resultat de l'electroforesi és el frotis. Si l’abundància d’ARN és baixa, no es mostrarà cap producte en electroforesi, però això no vol dir que cap producte s’amplifiqui per PCR. En general, es pot utilitzar referència interna per detectar ADNc. Si la referència interna té resultats, la qualitat de l'ADNc es pot garantir bàsicament (en alguns casos, si el fragment del gen diana és massa llarg, pot haver-hi excepcions).
2. Si hi ha un gen conegut amplificat per aquesta plantilla, es pot verificar mitjançant els primers d’aquest gen. L'amplificació de la referència interna no significa necessàriament que no hi hagi cap problema amb l'ADNc. Com que la referència interna té una gran abundància en ADNc, és fàcil d'amplificar. Si l'ADNc es parcialment degradat per diversos motius, des de la perspectiva de la probabilitat, els resultats de la PCR de gens objectiu de baixa abundància es veuran molt afectats. Tot i que la referència interna encara és elevada en abundància, l’amplificació probablement no es veurà afectada.
Degradar parcialment l'ARN. Detectar la integritat i la purificació de l’ARN
El contingut d’ARN de diferents espècies pot ser diferent, però, en general, l’ARN total extret hauria de contenir dues bandes clares 28S i 18S en electroforesi en gel i la brillantor de la banda anterior hauria de ser el doble que la de la segona. La banda 5S indica que l'ARN s'ha degradat i que la seva brillantor és proporcional al grau de degradació. L'amplificació amb èxit de la referència interna no significa que no hi hagi cap problema amb l'ARN, ja que la referència interna és en gran abundància, l'ARN es pot ampliar sempre que la degradació no sigui greu. El DO260/ OD280la proporció d’ARN pur mesurada per espectrofotòmetre ha d’estar entre 1,9 i 2,1. Una petita quantitat d’impuresa de proteïnes en l’ARN reduirà la proporció. Mentre el valor no sigui massa baix, la RT no es veurà afectada. El que més importa per a RT és la integritat de l’ARN.
L'extensió del gen de referència intern només pot indicar que RT ha tingut èxit, però no necessàriament està relacionat amb la qualitat de la cadena de cDNA. Com que els fragments de referència interns solen tenir una mida petita i una expressió elevada, és més fàcil tenir èxit en la transcripció inversa. No obstant això, la mida i l’expressió del gen objectiu varia d’un gen a un altre. La qualitat de l'ADNc no es pot jutjar només per referència interna, especialment per als fragments objectius de més de 2 kb.
Algunes mostres tenen estructures secundàries complexes, o tenen un contingut ric en GC, o són precioses amb poca abundància. En aquests casos, s’hauria de seleccionar la transcriptasa inversa adequada segons la mida del fragment objectiu i de la mostra. Per a plantilles d'ARN amb alt contingut de GC i estructura secundària complexa, és difícil obrir l'estructura secundària a baixa temperatura o amb transcriptasa inversa comuna. Per a aquestes plantilles, es pot seleccionar la transcriptasa inversa quant, ja que el seu rendiment de transcripció inversa és òbviament millor que el de la transcriptasa inversa de la sèrie M-MLV, que pot transcriure inversament diverses plantilles d'ARN de manera eficient i transcriure l'ARN a la primera cadena d'ADNc en la màxima mesura. Quan s’utilitza un kit general de transcriptasa inversa, el sistema de 20 μl només pot transcriure de manera efectiva 1 μg d’ARN total. Presteu atenció a la capacitat màxima de RT del kit. Si s’afegeix la plantilla en excés, la transcripció inversa afavorirà l’ARN amb molta abundància. Per tant, és millor no superar la capacitat màxima del sistema.
A-1 Determineu si l'ARN es degrada greument i si la RT té èxit
En general, la raó del fracàs de l'amplificació de referència interna sovint és causada per una greu degradació de l'ARN. Un altre motiu possible és el fracàs de la transcripció inversa. La referència interna no es pot utilitzar com a estàndard per jutjar la qualitat de cadena única de cDNA, però es pot utilitzar com a estàndard per jutjar si la transcripció inversa té èxit si no hi ha cap problema de qualitat de l'ARN. El més important en el procés de transcripció inversa és mantenir una temperatura constant i un sistema de reacció constant per millorar l’eficiència de la reacció.
A-2 Determineu si els primers per amplificar gens de referència interns són fiables i si hi ha problemes amb els reactius utilitzats en PCR.
Per a la quantificació relativa, l'ARN s'ha de quantificar abans de la transcripció inversa, cosa que també es requereix en molts kits de transcripció inversa, per exemple, quantificar l'entrada d'ARN com a 1 μg. Atès que l’ADNc transcrit inversament és una solució mixta, que inclou ARN, oligo dT, enzim, dNTP i fins i tot una mica de residu d’ADN, es produirà desviació, de manera que és impossible quantificar amb precisió l’ADNc. Per tant, és necessària la quantificació de l’ARN. Tenint en compte que l’eficiència de la transcripció inversa és la mateixa entre diferents mostres, la quantitat d’ADNc obtinguda hauria de ser la mateixa i l’anàlisi quantitativa pot mostrar la comparació dels nivells d’expressió de diferents gens en la mateixa quantitat d’ARN total. Quan es realitza una PCR quantitativa de fluorescència relativa, és possible que no sigui necessari l'ADNc quantitatiu després de la transcripció inversa perquè el gen de referència intern pot actuar com a referència.
Es relaciona principalment amb els gens, i la transcripció inversa del fragment llarg no és factible per a la majoria dels gens. En primer lloc, l'eficiència de la transcripció inversa és molt inferior a la de la PCR. En segon lloc, la regió rica en GC i l’estructura secundària de molts gens restringeixen la transcripció inversa i la PCR. Finalment, la fidelitat i l’eficiència d’amplificació de la PCR són difícils de garantir alhora. En el procés de transcripció inversa, ningú no pot garantir l'obtenció d'un fragment llarg per als gens de còpia baixa, especialment amb l'oligo dT. Pel que fa a 5 'UTR amb més GC, és encara més difícil. Per tant, segueix sent un mètode raonable per invertir la transcripció amb primers inicials aleatoris, trobar els llocs naturals de clivatge al fragment objectiu, amplificar-los per segments i després realitzar la digestió i lligament de restricció. En general, és difícil amplificar directament fragments de més de 2 kb, però no sempre és impossible obtenir: 1. En primer lloc, garantir la integritat de l’ARN / ARNm i es prefereix l’extracció de TRIZOL. 2. El kit M-MLV RT-PCR es pot utilitzar directament. Amplieu el temps de recuit i augmenteu correctament el nombre de cicles en el procés d’amplificació. Alternativament, es pot aplicar PCR nidificada o dur a terme una o dues reaccions primer amb una desnaturalització i un temps d’extensió adequadament estès abans de l’amplificació normal de PCR, cosa que pot ajudar a estendre fragments. Presteu atenció a la fidelitat de la polimerasa. 3. Long Taq es pot utilitzar en PCR per obtenir resultats ideals. 4. Per a l'aplicació d'expressió de proteïnes, s'ha d'aplicar polimerasa d'alta fidelitat.
Hi ha dos tipus de transcriptasa inversa que ofereix TIANGEN: Quant / King RTase i TIANScript M-MLV. La principal diferència entre ells és la quantitat d’entrada de plantilles. Quant és una transcriptasa inversa única, que és diferent de l'M-MLV d'ús comú derivat del virus de la leucèmia murina Moloney. Quant és una nova transcriptasa inversa d’alta eficiència expressada de manera recombinant per l’enginyeria Escherichia coli. Quant és adequat per amplificar 50 ng-2 μg d’ARN amb alta activitat transcripcional inversa i alt rendiment. En comparació amb MMLV o AMV normals, la característica més gran de Quant és que té una afinitat molt forta amb les plantilles d'ARN i pot invertir plantilles complexes de transcripció sense desnaturalitzar a alta temperatura. Per a les plantilles amb contingut de GC més alt, l’eficiència inversa és més alta. No obstant això, aquesta transcriptasa inversa té activitat RNasa H, que pot afectar la longitud del producte d'ADNc (adequat per a plantilles de <4,5 kb). Per a la transcripció inversa convencional, es recomana la transcriptasa inversa TIANScript MMLV. Aquesta RTasa és un enzim modificat amb una activitat RNasa H molt feble, que és adequat per a una síntesi llarga (> 5 kb) d'ADNc.
La transcripció inversa d’un pas i l’amplificació per PCR es completen al mateix tub sense obrir la tapa del tub entre la síntesi i l’amplificació de cDNA, cosa que és útil per reduir la contaminació. Com que totes les mostres d’ADNc obtingudes s’utilitzen per a l’amplificació, la sensibilitat és més elevada, amb un mínim de 0,01 pg d’ARN total. Per a un RTPCR d’un pas amb èxit, els primers específics de gens s’utilitzen generalment per iniciar la síntesi d’ADNc. El mètode en dos passos, a saber, la transcripció inversa i l'amplificació per PCR, es realitza en dos passos. En primer lloc, es realitza la transcripció inversa a partir d’una plantilla d’ARN per obtenir cADN, i l’ADNc obtingut se sotmet a una o més reaccions de PCR diferents. El mètode en dos passos pot utilitzar oligo (dT) o primers aleatoris per guiar la síntesi de la primera cadena de cDNA, i pot transcriure de forma inversa tota la informació de l'ARNm d'una mostra específica.
Categories de productes
PER QUÈ ENS TRIEM?
Des de la seva creació, la nostra fàbrica ha estat desenvolupant productes de primer nivell mundial seguint el principi
de qualitat primer. Els nostres productes han guanyat una excel·lent reputació a la indústria i una confiança valuosa entre clients nous i antics.








